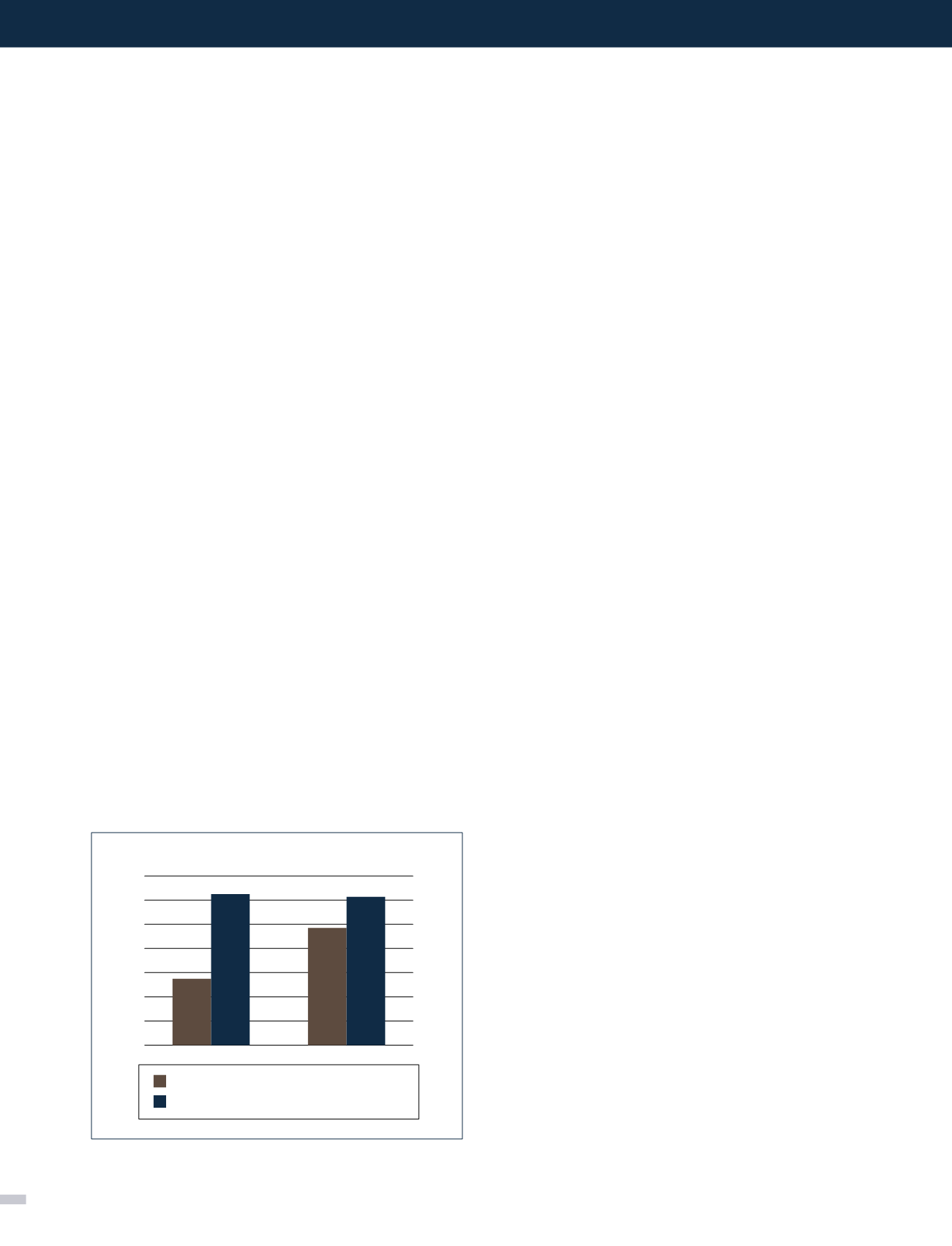
206
el primero. En modelos experimentales con ratas sometidas
a nefrectomía 5/6, aparece una enfermedad glomerular
absolutamente independiente del daño producido por la
cirugía, que se caracteriza por proteinuria y progresión de la
insuficiencia renal. La histología muestra hipertrofia y esclerosis
focal y segmentaria en los glomérulos remanentes (10). En
ese modelo es evidente que después del factor productor
de insuficiencia renal, la nefrectomía 5/6, se agregan otros
responsables de la enfermedad glomerular y la progresión del
daño renal. Hay evidencias experimentales que el aumento del
flujo plasmático renal (QB), presión del capilar glomerular (PCG)
la consecuente hiperfiltración que aparece en las nefronas
remanentes es la causa del daño glomerular agregado a la
condición de fondo y progresión del daño renal. A la semana
de nefrectomía 5/6 en ratas machos Munich-Wistar se observa
que la PCG de las nefrectomizadas 5/6 respectivamente es
63mmHg vs 49mmHg en las controles y la (taza de filtración
glomerular por nefrón aislada (SNGFR) es de 62nL/min vs
28nL/min. (Figura 1). Estos cambios funcionales se acompañan
de alteraciones estructurales iniciales como gotas de
reabsorción proteica en las células epiteliales, fusión podocitaria
y expansión del mesangio (11). Lo mismo ha sido demostrado
en ratas diabéticas (12, 13). Ello ocurre por trasmisión de
la hipertensión sistémica al glomérulo y constricción de la
arteriola eferente (A Ef) por acción de angiotensina II (A II) y
endotelina - 1 (ET-1). El aumento de la PCG y QB determinan
daño mecánico del endotelio, con liberación de citoquinas
como TGF-b (Transforming Growth Factor-b) y PDGF
(Platelet
Derived Growth Factor)
que inducen en las células mesangiales
un aumento de la formación de matriz y colágeno. La A II y ET-1
también actúan como factores de crecimiento y estimulan
la liberación de las citoquinas ya mencionadas. Además
con el aumento de la PCG hay un mayor tráfico de proteínas
hacia mesangio, lo que estimula la proliferación de células
mesangiales, formación de matriz mesangial y colágeno. De tal
manera que la proteinuria, favorecida por aumento de la presión
capilar glomerular, es factor independiente de progresión del
daño glomerular (14, 15).
Uno de los soportes más convincentes de la importancia de
los factores hemodinámicos en la producción y progresión de
nefropatía diabética en humanos ha sido el haber encontrado
en la autopsia de un diabético, la presencia de nefropatía
diabética unilateral, estando ausente en el riñón contralateral.
Este último, el riñón sin nefropatía diabética, tenía una estenosis
de su arteria renal, de lo cual se deduce que sus glomérulos
estaban protegidos de la HTA e hiperfiltración, única diferencia
con el riñón enfermo, ya que ambos estaban expuestos a los
mismos trastornos bioquímicos de la diabetes (16, 17).
La reducción de la PCG protege al glomérulo del daño
producido por hiperfiltración. Si se bloquea el (Eje R-A-A)
Renina-Angiotensina–Aldosterona, baja la PCG por reducción
de la presión arterial sistémica y dilatación de la A Ef por
desaparición de la acción de la AII sobre esta.
Anderson y cols (12) estudiaron la hemodinámica glomerular,
aparición de albuminuria y obsolecencia glomerular en tres
grupos de ratas machos Munich-Wista hechas diabéticas
mediante estreptozotocina y un grupo de no diabéticas
usadas como control (C). En las diabéticas un grupo solo
recibió insulina (DM). El segundo grupo de diabéticas recibió
insulina y Captopril (DM+Capt) y el tercer grupo insulina más
triple terapia anti HT de la época, reserpina, hidralazina e
hidroclorotiazida. (DM+RP Clásico). La reducción de presión
arterial (PA) fue comparable en las tratadas con Captopril
(-21mmHg) y las con terapia clásica (-30mmHg). A las 6
y 10 semanas, las ratas diabéticas sin terapia mostraron
elevación de velocidad de filtración glomerular por nefrona
intacta (SNGFR) debido a las elevaciones del flujo plasmático
renal y de la presión del capilar glomerular (PCG) pero, en
las DM+CAP y las DM+RP Clásico la reducción de PA se asoció
con la normalización selectiva de la PCG, sin cambiar en
SNGFR. A las 70 semanas las ratas DM desarrollan marcada
albuminuria y esclerosis del 12% de los glomérulos.
Las DM+CAP tuvieron escasa albuminuria y sólo un 0.4% de
los glomérulos esclerosados mientras que la terapia clásica,
sólo sirvió para retrasar, pero no para prevenir, el aumento
de la albuminuria aunque fue capaz de reducir la esclerosis
glomerular a un 4%. Sin embargo, el Captopril fue 10 veces
más eficaz, con sólo un 0,4% de glomérulos esclerosados
(Figura 2). Estos resultados confirman la observación clínica
que el tratamiento anti hipertensivo previene o detiene o
Figura 1. Velocidad de filtración glomerular
por nefrón aislado (SNGFR) y presión del capilar
glomerular (PCG)
Adaptado de Hostetter
et al
Referencia 11.
Control,
SNGFR,
28
Control,
PCG, 49
Nef %/6,
SNGFR,
63
Nef %/6,
PCG, 62
VFG
Controles
Riñones de ratas con ablación renal 5/6
[REV. MED. CLIN. CONDES - 2016; 27(2) 204-212]








