464
gen
TTN
con 313 exones, cuyas mutaciones pueden producir
Miocardiopatía dilatada, Displasia arritmogénica ventricular,
Miocardiopatía hipertrófica y diversos tipos de miopatías y
distrofias musculares con diversos grados de severidad y modelo
hereditario.
Uno de los mayores avances en estos últimos años, ha sido
definir la base genética de enfermedades cardiovasculares,
particularmente asociadas a muerte súbita. Hoy se conocen
más de 40 enfermedades cardiovasculares en las cuales se han
identificado una causa genética, entre ellas, miocardiopatías de
diferentes tipos, diversos trastornos del ritmo cardíaco inclu-
yendo varias canalopatías y un grupo de trastornos asociados
a aneurismas de aorta torácica, con la identificación de más de
200 genes para los que se han desarrollado paneles de estudio
por resecuenciación dirigida.
Actualmente, este tipo de paneles se aplican en enfermedades
neurogenéticas como Charcot-Marie-Tooth, ataxias, paraple-
jias, miastenia, miopatías, distrofias musculares. Igualmente
se han desarrollado paneles para hipoacusias, cáncer familiar
incluyendo genes de alta y moderada penetrancia, trastornos
visuales, epilepsia, discapacidad intelectual, enfermedades
mitocondriales, enfermedades metabólicas, incrementando
la tasa de pacientes diagnosticados desde el punto de vista
molecular.
NGS utiliza una combinación de nuevas estrategias en la prepa-
ración de muestras de ácidos nucleicos, nuevos métodos de
secuenciación de ADN y nuevos enfoques para la alineación y
el montaje del genoma, siendo posible un análisis genético de
todos los genes descritos en pocas semanas, disminuyendo su
tiempo de estudio que previamente era de meses o años, mejo-
rando la efectividad y eficiencia en el diagnóstico, al identificar
un alto número de variantes de ADN que pueden actuar como
mutaciones patogénicas responsables de la enfermedad o como
modificadores de la expresividad fenotípica (44). Estos avances
tienen mayores implicaciones para la práctica clínica ya que se
necesita integrar estos hallazgos genéticos en el manejo clínico
de los pacientes como herramienta diagnóstica y, en el futuro,
establecer el pronóstico y posibles tratamientos personalizados,
sin dejar de lado la detección de familiares en riesgo que
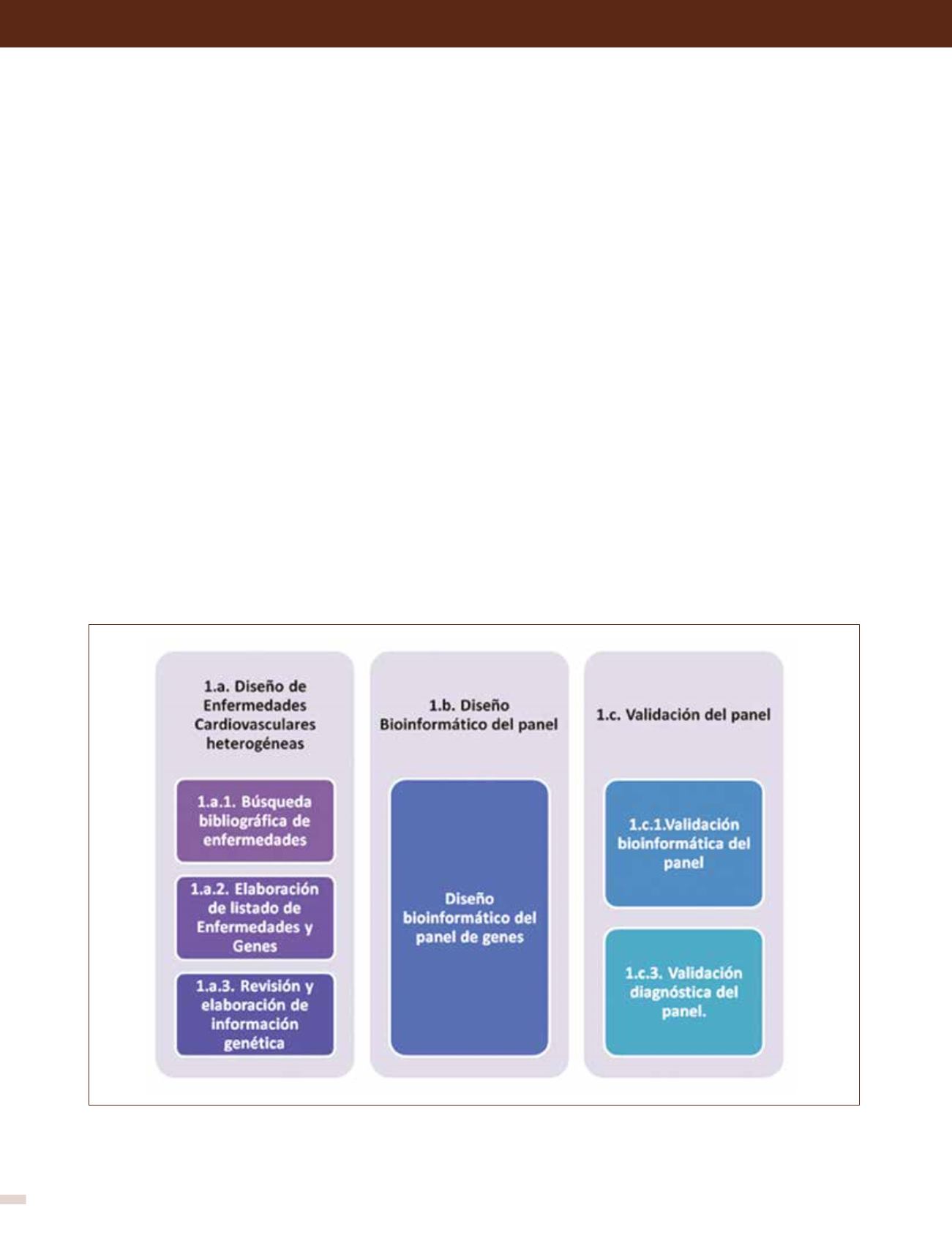
FIGURA 3. Modelo de diseño y validación del panel de enfermedades cardiovasculares heterogéneas
La fase 1.a. corresponde al diseño de un panel de genes aplicados a enfermedades cardiovasculares. Incluye la búsqueda de información clínica y
genética. En la fase 1.b. se encuentra el diseño bioinformático del panel para su fabricación. La fase 1.c corresponde a la evaluación bioinformática del
diseño y a la validación diagnóstica con muestras clínicas conocidas para establecer su sensibilidad y especificidad.
[REV. MED. CLIN. CONDES - 2015; 26(4) 458-469]








