465
deben integrarse a programas preventivos de la enfermedad
y el asesoramiento genético familiar sobre bases moleculares
concretas.
Sin embargo, es indispensable que el diagnóstico molecular
aplicando paneles de resecuenciación dirigida sea validado
previamente, estableciendo flujogramas de trabajo consen-
suados que lleven a la interpretación correcta de las variantes
detectadas, a la integración a bases de datos de forma auto-
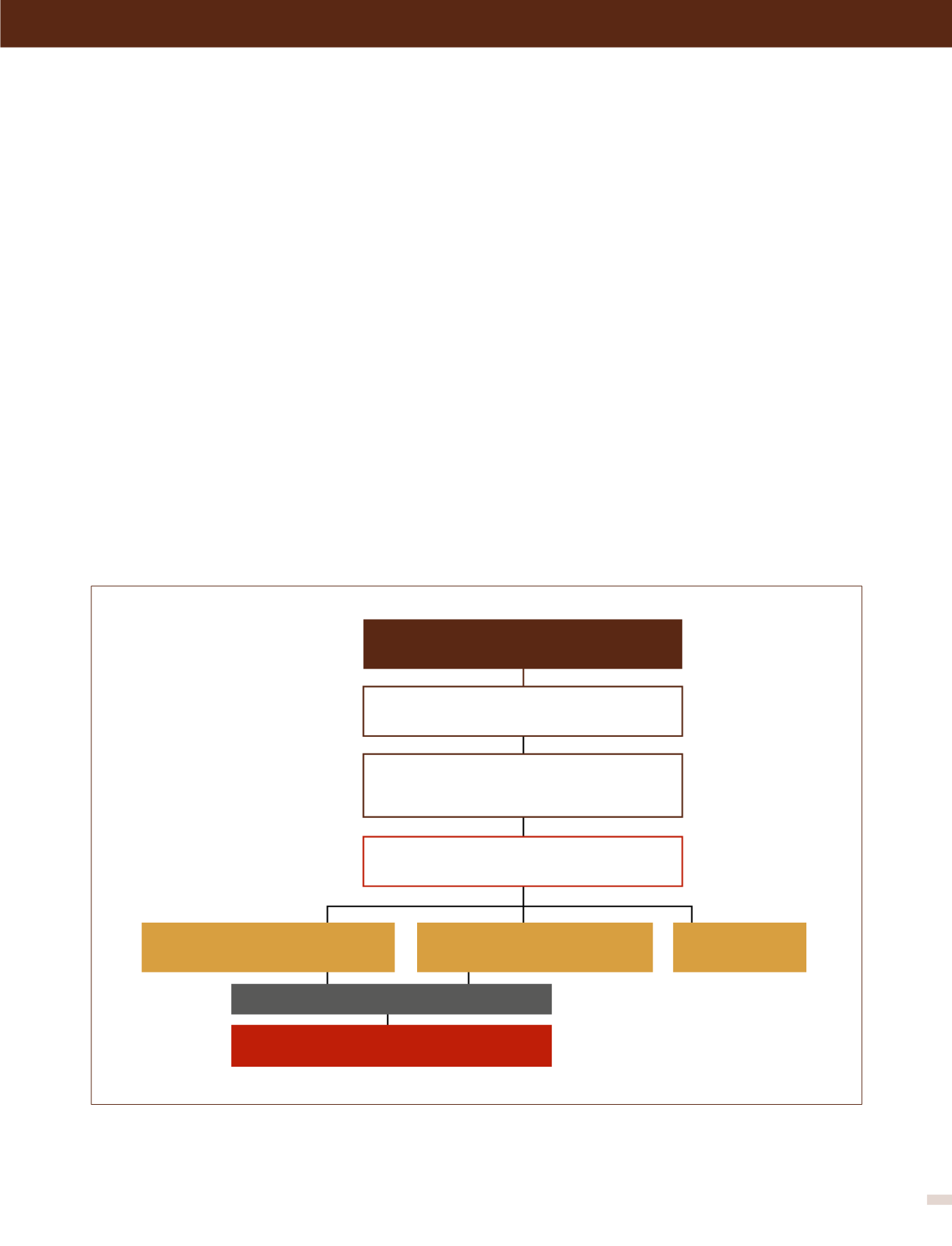
mática y a la revisión de estudios anteriores (45), Figura 4.
Aunque estos avances han aportado un nuevo conocimiento,
es necesario implementar guías consensuadas para el manejo
de la enorme cantidad de información genética generada
para el análisis, la interpretación biológica y clínica y la
información al paciente y su familia. Igualmente, son indis-
pensables nuevos desarrollos y actualizaciones de bioinfor-
mática, estudios de cosegregación familiar, demostración
de ausencia de la variante en la población normal y estudios
funcionales que permitan determinar el significado biológico
y la patogenicidad de las variantes identificadas, así como su
integración en bases de datos que permitan la correlación
genotipo-fenotipo.
Además, es necesario definir los aspectos bioéticos respecto
del derecho a conocer nueva información sobre genes que
no se encuentran en el panel de estudio, pero que a la vez,
puede ayudar en un nuevo diagnóstico de la enfermedad,
ya sea por fenotipos solapantes o por ausencia de signos a
la fecha de estudio, por lo que es indispensable el abordaje
multidisciplinario para establecer la correlación genotipo-fe-
notipo del afecto así como el manejo de familias con enfer-
medades genéticas heterogéneas (46).
La gran trascendencia de los resultados en el ámbito fami-
liar permite asesorar con alta precisión a aquellos familiares
en riesgo, estableciendo medidas de prevención dirigidas,
así como disminuir la angustia en aquellos familiares con un
FIGURA 4. Flujograma de diagnóstico clínico-biológico en paneles de secuenciación masiva
La clasificación de variantes detectadas por secuenciación masiva incluye la aplicación de algoritmos validados y actualización constante de información
científica y guías consensuadas, que permitan definir las variantes patogénicas y probablemente patogénicas que requieren ser confirmadas previamente
a la emisión del informe clínico biológico.
Confirmación por Secuenciación Sanger
Informe Clínico-Biológico
SNPs
Variantes de Significado
desconocido
Mutaciones patogénicas
Clasificación de
variantes
Análisis
In Silico:
Efecto sobre proteína
Efecto sobre mRNA
Consulta de base de datos
Sistema de filtrado de variantes
[EL DIAGNÓSTICO MOLECULAR DE ENFERMEDADES GENÉTICAS - Sonia Santillán MD PhD y cols.]








