
757
ción de una cepa bacteriana o fúngica por espectometría de
masas, depende de que el perfil proteómico de esa cepa esté
incluido en la biblioteca de perfiles del equipo, es así que las
especies “misceláneas” de la tabla, tienen un menor grado
de identificación, posiblemente por ser cepas aisladas con
menor frecuencia y por ende, menos representadas en esta
biblioteca o base de datos (12).
El análisis proteómico de microorganismos por espectrome-
tría de masas (MS) es una metodología confiable, económica
y rápida, que muestra resultados promisorios al compararlo
con métodos convencionales (MC). Se han publicado reportes
que indican que MS puede ser utilizado con buenos resul-
tados en la identificación a partir de muestra directa, con
protocolos publicados para urocultivo y hemocultivo, desta-
cando el aporte que esto significa en el manejo clínico. Sin
embargo, la aplicación de los protocolos publicados para
hemocultivo, resulta laboriosa e interrumpe el flujo normal
de trabajo de un laboratorio, ya que en el momento en
que un hemocultivo da alarma de positivo, debe haber un
profesional disponible para realizar la secuencia completa
de concentración-centrifugación y resuspensión de pellet
que indica el procedimiento, lo que no siempre existe en la
práctica diaria. En nuestro centro aplicamos este protocolo
el año 2012 en 39 muestras de hemocultivo, logrando un
74% de diagnóstico directo, que se veía fuertemente redu-
cido si el frasco de hemocultivo tenía resina/carbón activado.
Dado que este resultado no fue satisfactorio, se mantuvo el
método convencional de identificación (incubación por 18
horas en placas y luego identificación de colonias). Durante
el primer semestre de 2014, establecimos un algoritmo
acortado del método tradicional, realizando una identifica-
ción a ciegas a partir de placas incubadas por 4 a 6 horas (sin
colonias visibles), para conocer la correlación del diagnós-
tico adelantado a ciegas por MS en hemocultivos positivos
inoculados en placas de agar sangre, comparado con método
convencional (MC), según tipo de frasco y tipo de microorga-
nismo. Se incluyó en el estudio 145 muestras de hemocultivo
positivo detectados por equipo Bact /Alert. Los resultados de
ambos procesos fueron comparados en relación a resultado
de identificación. Se toma en cuenta el tipo de frasco y tipo
de microorganismo detectado. Los resultados se muestran
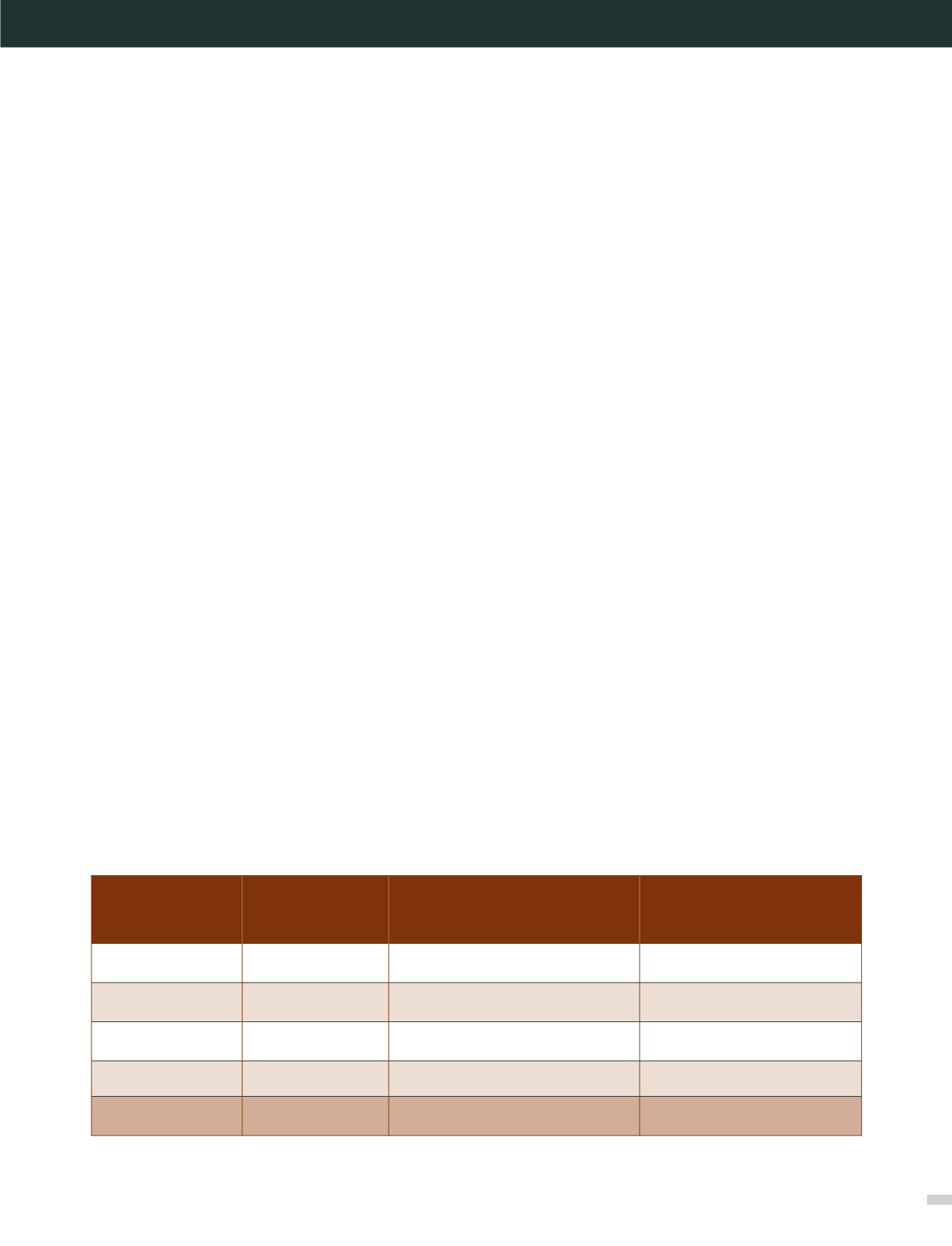
en Tablas 4 y 5, evidenciando que el estudio de hemocul-
tivos positivos en forma directa por MS, sembrando a ciegas
a las 4 a 6 horas de inoculación en placas, permite identificar
en forma segura el 81% de los casos, adelantando el dg en
12-16 horas respecto del método tradicional. Este resultado
mejora cuando se utilizan frascos sin resina o carbón activado
(dg correcto en 93% de los casos), y se observa mayor preco-
cidad para diagnosticar bacilos Gram negativo que cocáceas
Gram positivo. En base a estos resultados, se estableció un
algoritmo que se muestra en Figura 2, que permite adelantar
la ID sin aumentar los costos ni la carga de trabajo del labora-
torio de microbiología (13, 14).
Estudios de susceptibilidad
En cuanto a estudios de susceptibilidad a antimicrobianos,
existen diferentes metodologías, que se pueden sistema-
tizar en: convencionales o fenotípicos, y automatizados ya
sea fenotípicos o genotípicos. Cada vez más, se hace nece-
sario detectar de manera oportuna y precisa, la existencia de
mecanismos de resistencia con implicancia epidemiológica,
como son:
Enterococcus
resistentes a vancomicina,
S. aureus
con sensibilidad reducida a vancomicina, enterobacterias
productoras de Betalactamasas de Espectro Extendido (BLEE)
o productoras de carbapenemasas. Estos mecanismos de
resistencia pueden ser detectados por técnicas rápidas, de
screening
, o confirmatorias, ya sea fenotípicas o genotípicas,
que deben estar disponibles para realizar frente a una alerta
Tabla 4. Rendimiento de Identificación precoz, según tipo de frasco hemocultivo positivo, por Vitek MS
Tipo de frasco
n° tot positivos
n° identificación precoz
concordante con identificación
18 hrs
% identificación
precoz concordante
FA
53
35
66
PF
21
14
67
SA
54
50
93
SN
17
16
94
Total
145
115
79,3
FA y PF: frascos con carbón activado. SA, SN: frascos sin carbón activado.
[Nuevas tecnologías en diagnóstico microbiológico... - Dra. Beatrice Hervé E.]









