457
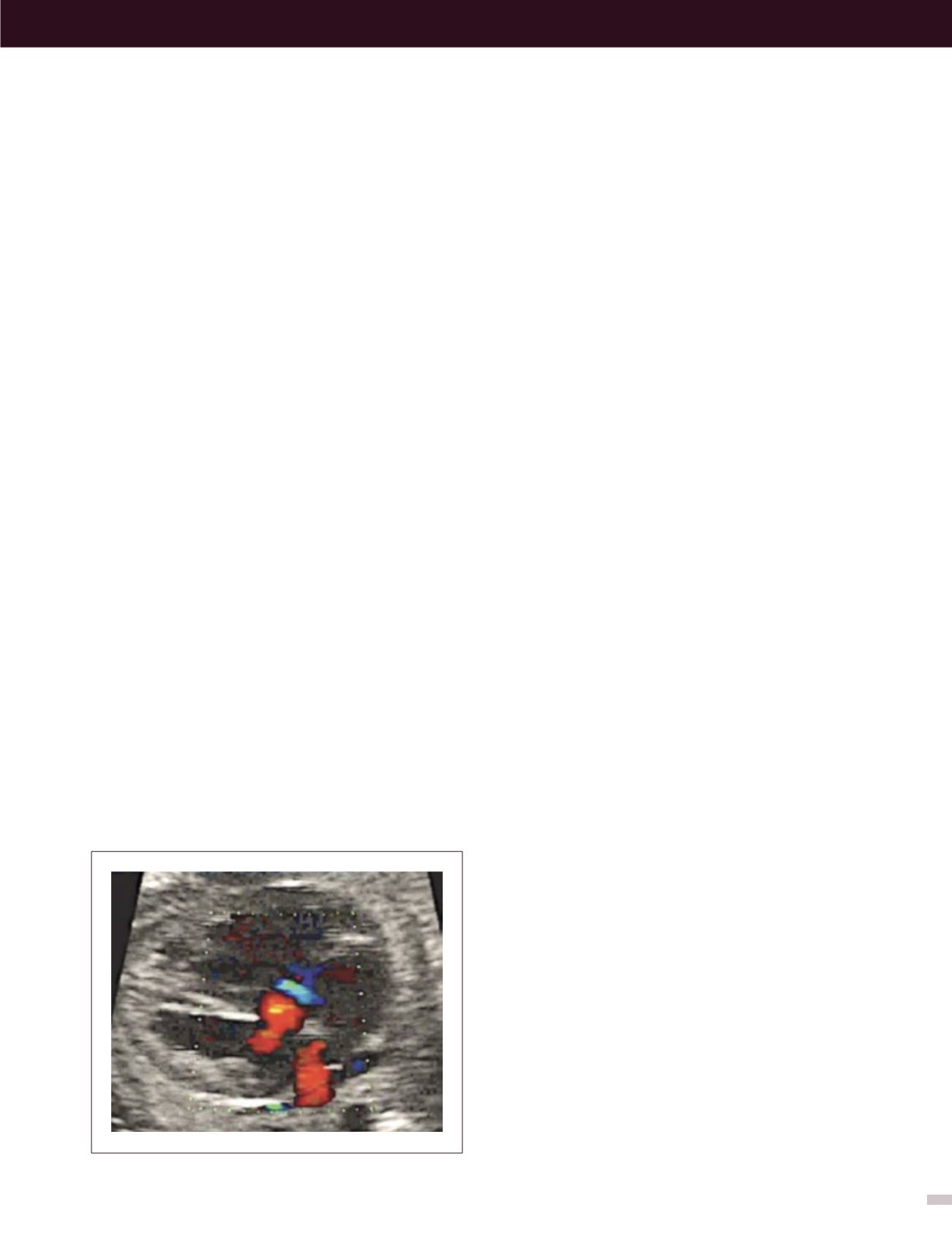
FIGURA 13. CIA s
eptum primum
Estas son aproximadamente el 8% de las malformaciones
cardiacas (26). Las podemos dividir en causas extrínsecas
e intrínsecas. Las extrínsecas generalmente se deben a
infecciones, hipervolemia y menos frecuentemente a
daño miocárdico por anticuerpos Ro SSa o SSb como lo
describiremos en el bloqueo AV completo. En los casos
de infección, los virus de la rubéola, citomegalovirus,
herpes y parvovirus B19 son los más frecuentemente
identificados (26). Entre las causas intrínsecas observamos
las miocardiopatías. En estos casos también se observa
el corazón aumentado de volumen pero con una función
contráctil alterada incluso con zonas aquinéticas. Las más
frecuentes son la miocardiopatía dilatada y la falta de
compactación del miocardio.
Las alteraciones del eje cardíaco son generalmente con
un aumento por sobre los 60º. Las causas más frecuente
son alteraciones de los tractos de salida o eventualmente
compresiones extrínsecas. Al examen observamos un
corazón “recostado” en el tórax con un ángulo mayor de
90º. El pronóstico va a depender de la causa por la cual el
eje está alterado.
Defectos septales auriculares.
El defecto tipo
septum
primum
es el más frecuentemente diagnosticado en
la vida intrauterina y corresponde a grados variables
de canal atrio-ventricular, el doppler color permite
identificar la zona de defecto (Figura 13). El defecto tipo
septum secundum
es menos frecuente y forma parte el
síndrome de Holt-Oram (27).
Debido a las características de la circulación fetal, en que
la presencia del foramen oval impide la identificación
adecuada del
septum
interauricular, se debe sospechar de
comunicación interauricular en el corte de 4 cámaras al
identificarse una ausencia completa o parcial del
septum
primum
y una inserción septal anómala de las válvulas
AV (inserción en línea). El diagnóstico antenatal de los
defectos tipo
septum
secundum
son extremadamente
infrecuentes. (28)
Defectos septales ventriculares.
La comunicación
interventricular (CIV) es frecuentemente diagnosticada
en el neonato al igual que en el feto, con una incidencia
estimada de 0.38/1000 recién nacidos vivos (29). Son
clasificados de acuerdo a su ubicación en subpulmonar,
perimembranoso (Figura 14a), que son los más frecuentes
(80%) y están ubicados bajo la válvula aórtica; en el tracto
de entrada del ventrículo derecho y, por tanto, pueden
comprometer la inserción de las cuerdas tendinosas de la
válvula tricúspide; y trabecular, localizado en la porción
muscular del septum. Estos defectos son generalmente
asintomáticos en la vida intrauterina y neonatal.
El diagnóstico antenatal está basado en la identificación
de un defecto del
septum
interventricular, con modo B
(30) que tiene una sensibilidad limitada la que mejora
significativamente utilizando Doppler color o de
amplitud (Figura 14b). La mayoría de los defectos se
pueden visualizar en el corte de cuatro cámaras y el corte
de 5 cámaras ayuda para identificar las comunicaciones
interventriculares perimembranosas de salida y definir
el grado de cabalgamiento de la aorta sobre la parte
superior del tabique interventricular. La presencia de un
flujo bidireccional por el defecto nos indica que existe
un gradiente de presiones relativamente similares
entre ambos ventrículos (30). La presencia de flujo
unidireccional indica la existencia de una malformación
en los tractos de salida. Debemos tener en cuenta que
para una visualización adecuada con modo B o Doppler
color debemos realizar una aproximación lateral y
recorrer el septum en toda su extensión, en busca de la
zona con defecto. El eje corto también ayuda a corroborar
la localización más específica de la comunicación.
(Figura 14c). La visualización de los defectos en 3D
también es posible y evidencia la condición espacial
de los defectos (Figura 14d). La CIV en vida fetal tiene
una asociación a otras malformaciones (especialmente
otras cardiopatías CC), a cromosomopatías (mayor riesgo
de en CIV perimembranosas) y a síndromes génicos.
Ante el hallazgo prenatal de CIV se debe realizar un
estudio anatómico detallado, una ecografía avanzada
y en función de los hallazgos sugerir un cariotipo. Se
sugiere seguimiento ecográfico cada 4-6 semanas para
evaluar el tamaño y flujo a nivel del defecto, así como la
potencial aparición de alguna otra CC.
[Diagnóstico y manejo prenatal de patología cardíaca fetal - Dr. Hernán Muñoz y cols.]