690
Actualmente están comercializados en Chile 5 IP, que por
orden alfabético son: ATV, DRV, FPV, LPV y SQV. Como se
señalaba anteriormente RTV no se utiliza como antiretro-
viral, sino como booster o potenciador farmacológico a
bajas dosis. Últimamente se incorporó otro potenciador o
booster al mercado, el cobicistat el cual es un potenciador
selectivo del citocromo P450 de las isoenzimas CIP3A4,
y es un débil inhibidor del CIP2D6, no posee de induc-
ción enzimatica en comparación a ritonavir, y su impacto
en el perfil lipídico es levemente mejor que ritonavir. Se
encuentra asociado bajo el nombre de STRIBILD® (5,78).
INHIBIDORES DE LA FUSIÓN
En esta familia existe solo un representante: enfuvirtide
(T-20), el cual es capaz de inhibir la fusión de la cubierta
viral del VIH con la membrana celular, impidiendo el
ingreso del contenido viral en los linfocitos. Su actividad
frente al VIH es independiente de correceptor utilizado
(CCR5 y/o X4) y su perfil de resistencias es completamente
diferente al de los otros ARV. Su uso en la actualidad está
reservado para pacientes con virus multirresistentes. La
barrera genética de T-20 es baja y si no se acompaña de
otros fármacos activos rápidamente aparecen mutaciones
de resistencia, perdiendo su eficacia (5, 41).
T-20 se comercializa como Fuzeon® en jeringas de 90mg y
debe administrarse por vía subcutánea. La dosificación en
adultos es de 90mg cada 12hr y el paciente debe recibir
una capacitación para su autoadministración. Su efecto
adverso más característico es la aparición de máculas dolo-
rosas, por lo cual se debe rotar el sitio de inyección (42).
La biodisponibilidad tras su administración subcutánea
es del 80%. Se elimina mediante catabolismo de sus
aminoácidos constituyentes y no es sustrato ni influye
en la actividad de ninguno de los sistemas metabó-
licos de los otros ARV, por lo que no es susceptible de
presentar interacciones metabólicas relevantes. No se
requiere ajuste de dosis en insuficiencia hepática ni
renal. El resto de sus características farmacocinéticas se
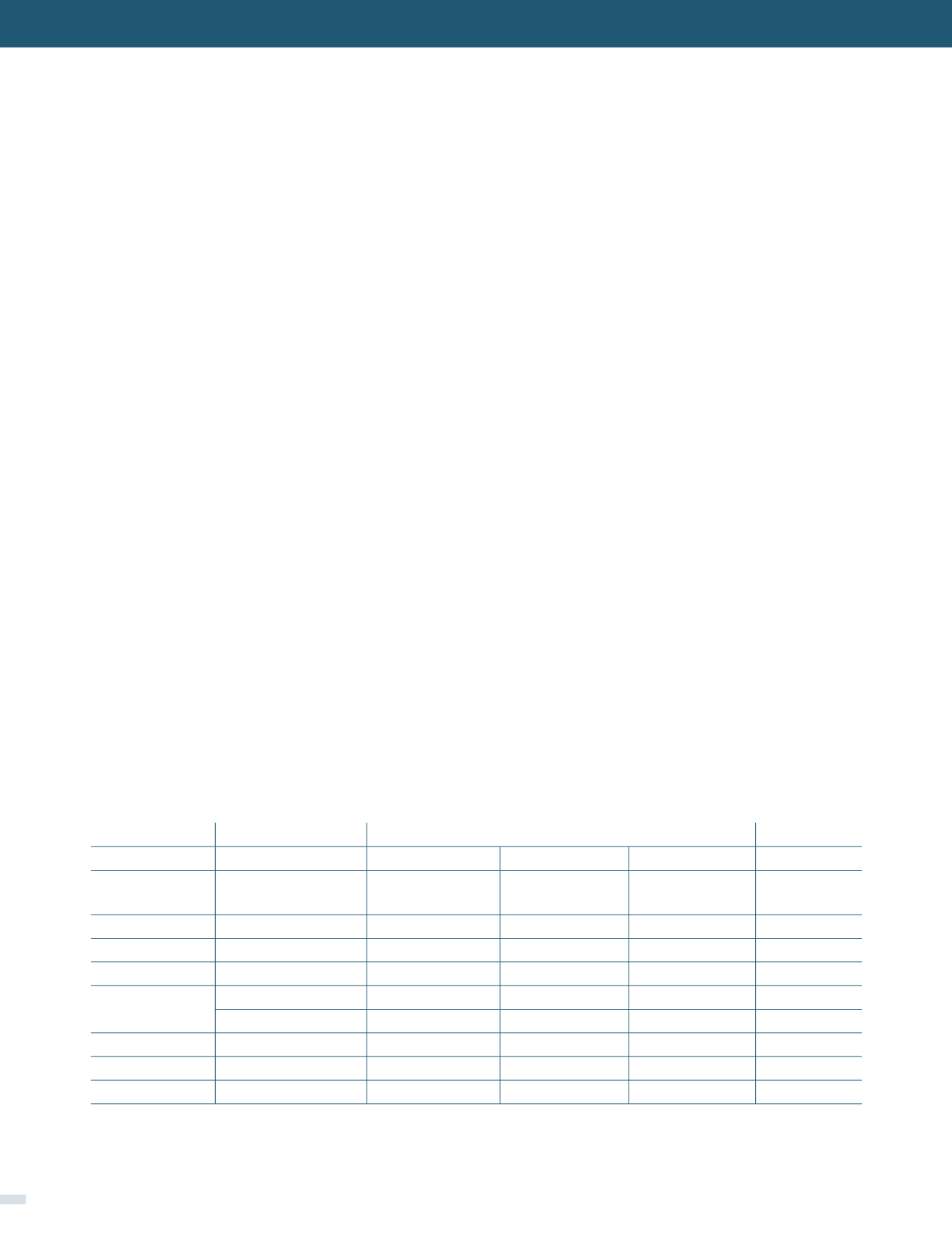
indican en la Tabla 5.
ANTAGONISTAS DE LOS CORRECEPTORES CCR5
Solo disponemos de un inhibidor de los correceptores
CCR5: maraviroc. MVC está indicado en el tratamiento
de la infección por el VIH-1 con tropismo CCR5 detec-
table mediante test tropismo validado y en combinación
con otros fármacos ARV. Actúa bloqueando la entrada del
VIH a las células humanas. No es eficaz frente a virus con
tropismo dual, mixto o X4 (5, 43).
MVC se comercializa como Celsentri® en comprimidos de
150 y 300mg. La dosis indicada en el adulto es de 150mg,
300mg o 600mg dos veces al día, dependiendo de las
interacciones con la terapia antirretroviral y con otros
medicamentos.
Sus características farmacocinéticas se indican en la
Tabla 5. MVC es sustrato de CYP3A4, pero no es inhibidor
ni inductor del mismo. Los inhibidores e inductores de
CYP3A4 alteran profundamente los parámetros farmaco-
cinéticos de MVC, recomendándose cambios en su dosis,
sin que MVC modifique significativamente las concentra-
T-20
INSTI
CCR5
Nombre
Enfuvirtide
Raltegravir
Elvitegravir
Dolutegravir
Maraviroc
Dosis
90mg c/12h s.c
400mg/ c12h
150mg
*coformulado
50mg/día –
50mg/12hr
Variable
BD
84 ± 15%
--
----
----
23-33%
T ½ p (hr)
3.8
9
8.7 - 13
14
13.3
Metabolismo
catabolismo
UDPGT
UDPGT /CIP3A
UDPGT /CIP3A
Comportamiento
AA
Hepático
Hepático
Hepático
Hepático/Renal
Fecal: 53%
UPP
92%
83%
99%
98.9%
76%
LCR
--
3
----
18nng/mL
3
Actividad
VIH-1
VIH-1,2
VIH-1
VIH-1
VIH-1CCR5
TABLA 5. CARACTERÍSTICAS FARMACOCINÉTICAS OTRAS FAMILIAS
BD: Biodisponibilidad, T1/2: Vida media plasmática, T1/”ii: Vida media intracelular, UPP: Unión a proteínas plasmáticas, LCR: Penetración a líquido céfalo
raquídeo, UDPGT: Uridinadifosfato glucuroniltransferasa.
Ref: Tabla confeccionada con datos extraídos de Micromedex® Healthcare Series y Lexi-comp® (76).
[REV. MED. CLIN. CONDES - 2016; 27(5) 682-697]








