
226
M.L. Polo
López
et al.
/ Cir Cardiov. 2016;
23(5)
:220–228
0
10
I
II
III
IV
1,3
6,5
47,6
23,4
Preoperatorio
Postoperatorio
38,1
68,8
8,3
6
20
30
40
50
60
70
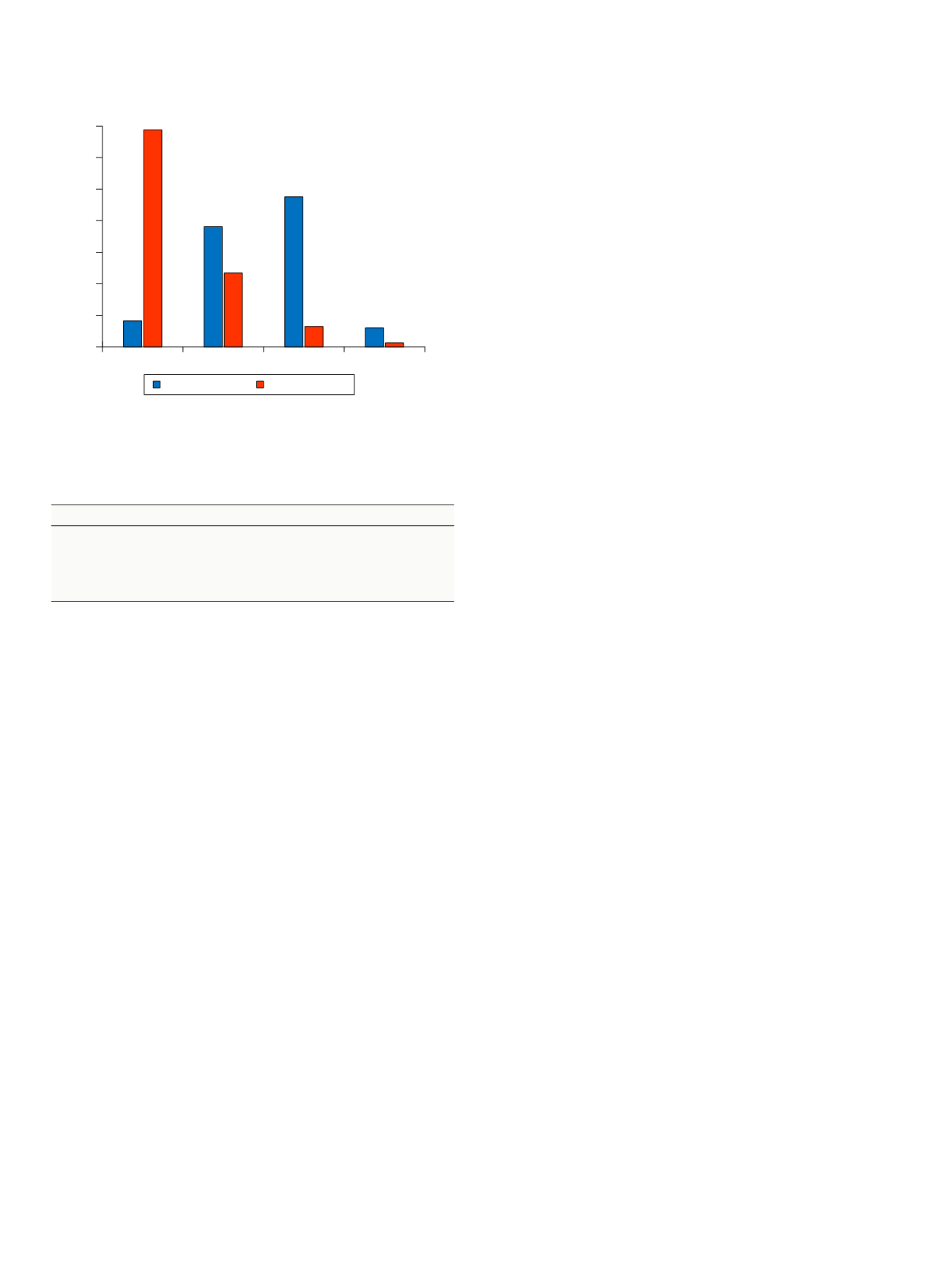
Grado funcional pre y postoperatorio
Figura 6.
Grado
funcional
(escala NYHA) expresado en porcentajes respecto al
total
de pacientes.
Tabla 6
Datos
correlacionados
de
23
pacientes
con
implante
de
bioprótesis
pulmonar
y
resonancia magnética pre y postoperatoria
Preoperatorio
Postoperatorio
p
FRP
(%)
41
±
27
6,6
±
7,8
0,001
VTSVD
(ml/m
2
)
111
±
38
68
±
31
0,001
VTDVD
(ml/m
2
)
183
±
60
113
±
36
0,001
FEVD
(%)
37
±
9
41
±
10
0,057
FEVI
(%)
54
±
11
56
±
10
0,49
En
las columnas desde
la
izquierda hasta
la derecha
se consignan,
respectivamente,
los valores preoperatorios, postoperatorios y
el valor p de
significación
estadística,
que
resulta de
la
comparación de
los valores anteriores.
En negrita aparecen marcados
los valores de p
con
significación estadística.
FEVD:
fracción
de
eyección
del
ventrículo
derecho;
FEVI:
fracción
de
eyección
del
ventrículo
izquierdo;
FRP:
fracción
de
regurgitación
pulmonar;
VTDVD:
volumen
telediastólico
del
ventrículo
derecho; VTSVD:
volumen
telesistólico
del
ventrículo
derecho.
Durante el seguimiento, en 31 pacientes (43%) se hizo cardiorre-
sonancia
de
control.
La
tabla 6 muestra
la
repercusión
que
tiene
sobre el VD el
implante de una bioprótesis pulmonar, objetivándose
disminución de
la
insuficiencia pulmonar y
reducción de
los volú-
menes del VD
significativas, aunque
la
contractilidad biventricular
no
se modifique.
Discusión
Nuestros
adultos
con
SF operados durante
su ni˜nez
sobrevivie-
ron
a
las
primeras
reparaciones
completas
realizadas
en
nuestro
país. Habitualmente,
presentan
grandes
ventriculotomías
e
insu-
ficiencia
pulmonar
severa
como
secuelas
asociadas
al
parche
transanular.
Sus
indicaciones
más
frecuentes
de
reintervención
(76,7%)
se
relacionan
con
la
patología
valvular
pulmonar
en
con-
sonancia
con
otras
publicacione
s 14 .Nuestra
segunda
causa
de
reintervención es
la patología valvular aórtica
(11,1%),
seguida por
los
defectos
septales
residuales
(7,8%)
y
la
patología
tricúspide
(4,4%).
La
insuficiencia
pulmonar
,
aunque
se
tolera
clínicamente
bien
durantemuchos a˜nos, sobrecarga de volumen al VD, que primero se
dilata y finalmente deteriora su contractilidad. Entonces aparece
la
clínica, acompa˜nada de disfunción ventricular
izquierda
si además
se altera
la
sincronía biventricular.
El
recambio
valvular
pulmonar
para
tratar
una
insuficiencia
pulmonar
severa
en
un
paciente
sintomático
y/o
con
progresiva
dilatación
o
disfunción
del VD
es
indudable.
El momento
ideal
de
hacerlo en
los asintomáticos no está clar
o 15 . Las guías clínicas valo-
ran
principalmente
para
indicar
una
reintervención
el
deterioro
clínico y/o
las arritmias relacionadas con
la
insuficiencia pulmonar.
En pacientes asintomáticos
importamás el progresivo deterioro del
VD medido con
resonancias seriadas que
los valores absoluto
s 16 , la
insuficiencia
tricúspide progresiva y
la existencia de otras
lesiones
residuales que
requieran
cirugía.
Respecto
al
sustituto
valvular
pulmonar
de
elección,
aunque
todos
los
que
actualmente
existen
en
el
mercado
tienen
dura-
ción
limitada
y
precisan
reoperaciones,
parece
haber
consenso
internacional
hacia
los
biológicos.
Los
homoinjertos
no
precisan
anticoagulación,
su
hemodinamia
inicial
es
excelente
y
en
jóve-
nes
asocian una degeneración precoz que
acorta
su durabilida
d 17 .Las bioprótesis no requieren anticoagulación permanente, su dura-
ción a 20 a˜nos
supera el 80
% 18 ypermiten hacer
intervencionismo
a
su
través.
Las
prótesis mecánicas
exigen
siempre
una
óptima
anticoagulación,
dificultan
o
imposibilitan
los
procedimientos
hemodinámicos
a
su
través y
en posición pulmonar no duran más
que
las bioprótesi
s 19 .La
prótesis
pulmonar
percutánea
es
un
abordaje
complemen-
tario
a
la
cirugía
prometedor,
aunque
actualmente
no
similar,
puesto
que
tiene
que
demostrar
una
durabilidad
equiparable
a
esta.
La
experiencia
reportad
a 20 muestra
escasas
complicaciones
periimplante
haciendo
coronariografía
y
pre-stent
previos;
en
2
a˜nos
de
seguimiento
medio,
hasta
un
30%
necesita
otro
nuevo
procedimiento
percutáneo
o
quirúrgico.
Las
complicaciones más
frecuentes son
las
fracturas del stent, que producen gradientes ele-
vados
con
disfunción
protésica,
necesidad
de
reintervenciones
y
endocarditis.
Por
todo
esto,
pensamos
que
debe
individualizarse
este
implante
percutáneo,
indicándolo
actualmente
de
manera
colegiada en pacientes
con prohibitivo
riesgo quirúrgico.
El
implante
quirúrgico
de
una
bioprótesis
elimina
la
insu-
ficiencia
pulmonar
y
permite
tratar
las
lesiones
asociadas.
Posteriormente,
los síntomas mejoran, se
reducen
los volúmenes y
lamasa del VD en casi todos
los pacientes, optimizándose el
llenado
ventricular
izquierdo y
la
sincronía biventricula
r 21 . Esta
reducción
del VD
se
observa
a partir de
los 6 meses postimplante
y
se
cuan-
tifica con
resonancia magnética, aunque su
recuperación contráctil
solo aparece operando en
las
fases
iniciales de dilatación. Los
jóve-
nes
sintomáticos
parecen
beneficiarse más
del
recambio
valvular
pulmona
r 22 ytambién
presentan mayor
deterioro
estructural
del
sustituto
pulmonar,
acortándose
su
durabilida
d 23 .La
bioprótesis
pulmonar no parece modificar
la
incidencia de
taquicardia ventri-
cular nimuerte súbita a lo largo del seguimient
o 24 , por lo que no hay
evidencia de una mejor supervivencia posterior de estos pacientes.
Actualmente,
se
recomienda
interponer
la bioprótesis
antes de
que el
fallo del VD sea
irreversible. Varios estudios comparan el VD
con
cardiorresonancia
pre
y
postinterposición
de
válvula
pulmo-
nar,
intentando
ajustar
el momento
idóneo
para
reoperar
las
SF,
indicando volúmenes
telediastólico y
telesistólico
inferiores
a 170
y 90ml/m
2
, respectivamente. Otros calculan
la
fracción de eyección
del VD
ajustándola
a
las
insuficiencias
valvulares
y
cortocircuitos
residuales (estos pacientes aumentan el gasto cardíaco paramante-
ner un adecuado flujo pulmona
r 25 ),observándose siempre mejoría
contráctil del VD
tras
la
interposición de una válvula pulmonar.
Nuestra
cirugía
de
recambio
valvular
pulmonar
aislado
tiene
resultados
óptimos,
sin mortalidad
hospitalaria.
Tampoco
falleció
ningún
paciente
portador
de
conducto
VD-AP
a
pesar
del
riesgo
asociado que
tienen por
su mayor número de operaciones previas.
Observamos
importantes
grados
de
dilatación
del
VD
que
preci-
saron
una
disección
laboriosa
de
sus
adherencias
con
canulación
periférica
previa,
prolongando
de
esta manera
los
tiempos
qui-
rúrgicos y
aumentando
el
riesgo de morbimortalidad hospitalaria.
Recomendamos
reoperar
a
estos
pacientes
porque mejoran
clíni-
camente
y
el
VD
se
reduce
tras
la
bioprótesis
pulmonar,
aunque
no
siempre mejore
su
contractilidad.
Consideramos
la
resonancia









