
655
cara extracelular en cada una de las interfaces entre una subu-
nidad
α
y una subunidad
β
(26,29,30). Es destacable que las
diferentes subunidades le confieren al receptor propiedades
biofísicas particulares, y localizaciones determinadas a nivel
del sistema nervioso central y a nivel de la sinapsis (27,29). Los
ligandos exógenos más conocidos de los receptores GABA
A
son
los anestésicos generales, el etanol y las benzodiacepinas. Los
anestésicos actúan sobre los receptores GABA
A
como modu-
ladores alostéricos positivos (PAM, por sus siglas del inglés).
Esto quiere decir que los anestésicos requieren GABA endó-
geno para poder activar al receptor (31). No obstante, a muy
altas concentraciones se comportan como agonistas directos
(32). Además, dependiendo las subunidades que componen al
receptor GABA
A
, los anestésicos producirán diferentes niveles
de potenciación y con diferentes cinéticas (33). Los sitios de
unión de los anestésicos en los receptores GABA
A
se han estu-
diado con mutaciones sitio dirigidas. De este modo, se ha
determinado que la serina 270 de las subunidades
α
es crítica
para el efecto PAM de isofluorano (32,34). Por otro lado, la
leucina 232 de las subunidades
α
cuando es mutada se pierde
el efecto del halotano (34). En cuanto a los anestésicos intrave-
nosos, se sabe que el sitio de acción estaría en las subunidades
β
2-3 (32,35). Específicamente, el efecto clínico de la adminis-
tración de propofol o etomidato se pierde al mutar la asparra-
gina 265 de la
β
2 (35). Posteriormente, con otras mutaciones
sitio dirigidas se han ido configurando los bolsillos hidrofó-
bicos donde actúan los anestésicos generales (32).
Los receptores GABA
A
al activarse disminuyen la capacidad de
las neuronas para generar un potencial de acción y, con ello,
la transmisión del impulso eléctrico. Esta disminución de la
excitabilidad neuronal ocurre porque la activación de GABA
A
genera una hiperpolarización o una inhibición tipo cortocir-
cuito de la excitabilidad neuronal (32,36). Esta inhibición
ocurre por la activación de los receptores GABA
A
sinápticos y
extrasinápticos, los primeros son receptores localizados en las
sinapsis neuronales y se caracterizan por generar una inhibi-
ción tipo fásica y tener una afinidad baja por GABA, mientras
los extrasinápticos están localizados alrededor de la sinapsis,
generan una inhibición tipo tónica y son altamente afines a
GABA (27,32,36). Los anestésicos actúan sobre ambos tipos
de receptores para generar los diferentes efectos clínicos. Por
ejemplo, los receptores que contienen la subunidad
α
5 son
extrasinápticos, se expresan particularmente en las células
piramidales del hipocampo, estructura fundamental en la
adquisición de la memoria, y explican la amnesia generada por
los anestésicos y aún más los posibles déficit de memoria que
ocurren transitoriamente tras una anestesia (4,37).
Otros blancos moleculares
Hoy es ampliamente aceptado que los anestésicos no solo
actúan sobre los receptores GABA
A
. En esta sección sólo
haremos una breve descripción estructural y funcional de
estos blancos moleculares.
Canales de potasio de dos poros:
son un subtipo de
canales de K
+
voltaje dependientes que mantienen el poten-
cial de membrana de reposo por medio de una corriente
“
background
”. Estructuralmente se conforman por 2 subuni-
dades donde cada una contiene 2 dominios de poro, carac-
terística que origina el nombre de estos canales. Entonces
al ensamblarse estas 2 subunidades, se conforma un único
poro permeable a K
+
rodeado por 4 dominios de poro,
donde cada dominio contiene un sensor de potencial para
abrir al canal (2,38). Estos canales se expresan en el sistema
nervioso central y se han descrito como un blanco de los
anestésicos inhalatorios (39).
Receptores de N-metil-D-aspartato (NMDA):
son
receptores ionotrópicos que se activan con glutamato.
Estructuralmente son un tetrámero y cada subunidad
consta de 4 dominios transmembrana. Desde un punto de
vista funcional corresponden a un canal catiónico no selec-
tivo, permeable a cationes mono y divalente, como Na
+
y
Ca2
+
. Su apertura lleva al ingreso de cationes a la célula,
lo que despolariza a la membrana plasmática y genera un
potencial postsináptico excitatorio. Es ampliamente acep-
tado que constituye un blanco molecular de diversos anes-
tésicos generales, como el xenón, la ketamina y el óxido
nitroso (2,40,41), los cuales actúan como antagonistas de
Cl
-
HCO
3
-
GABA
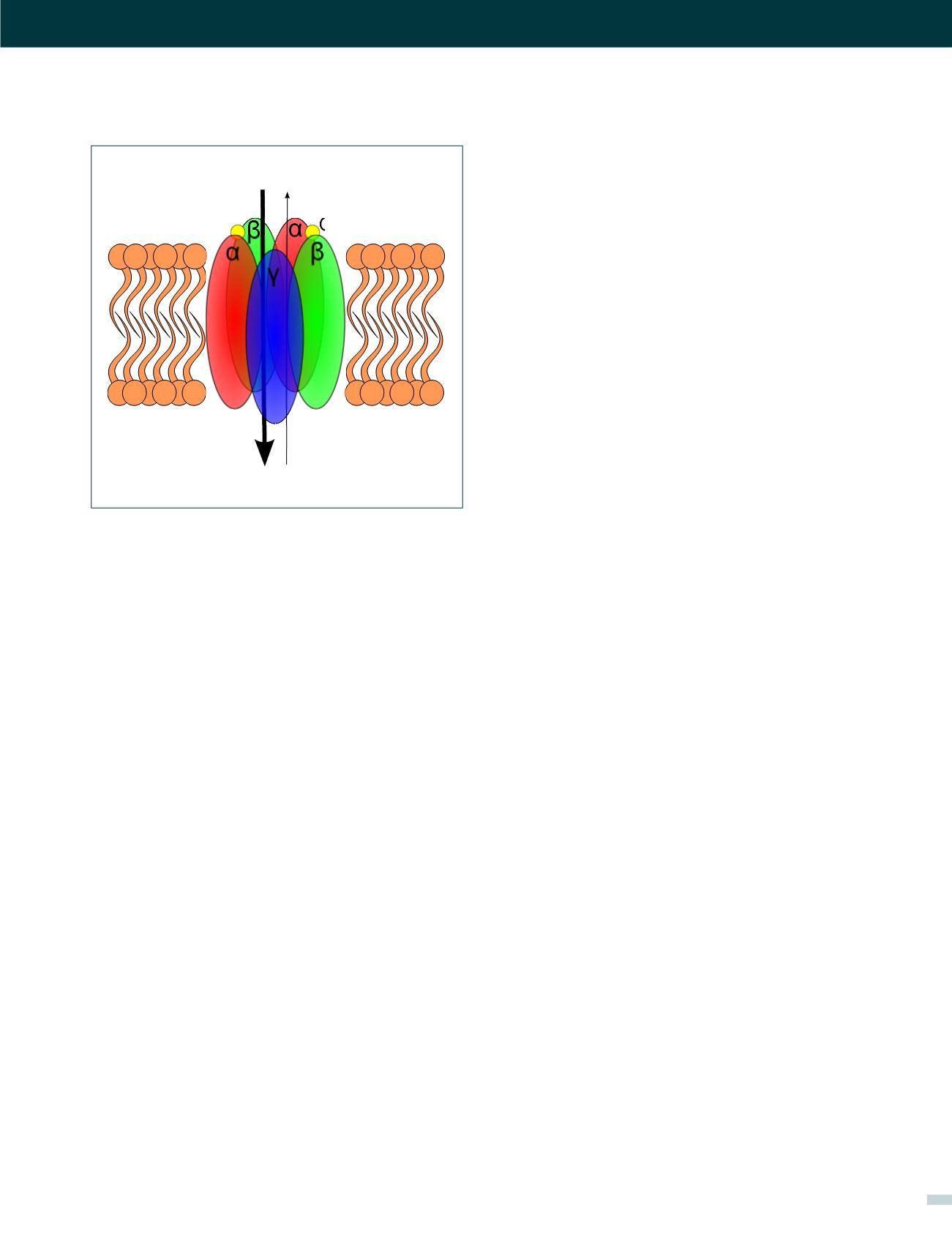
FIGURA 4. ESQUEMA DE UN RECEPTOR GABA
A
El receptor GABA
A
es un receptor ionotrópico que al activarse permite
el paso de Cl
-
y HCO
3
, siendo Cl
-
4 veces más permeable que HCO
3
-
.
El receptor se compone de 5 subunidades transmembrana, las cuales
habitualmente son las que se representan en el esquema:
αβαβγ
. El
receptor para activarse requiere de la unión de 2 moléculas GAB
A
, las que
se unen en ambas interfaces
αβ
lo que es representado en el esquema.
[NEUROCIENCIA Y ANESTESIA - Dr. Antonello Penna MD PhD y col.]
















